Hukum-Hukum Dasar Ilmu Kimia
- Hukum Kekekalan Massa
Antoine Lavoisier (1774) " Massa zat sebelum dan sesudah reaksi adalah samaatau tetap". - Hukum Perbandingan Tetap
Josep Louis Proust (1799) "Senyawa yang sama selalu mengandung unsur-unsur penyusunnya dalam perbandingan yang sama. - Hukum Perbandingan Berganda
John Dalton (1804) "Jika dua buah unsur dapat membentuk lebih dari satu macam persenyawaan, perbandingan massa unsur yang satu dengan yang lainnya adalah tertentu, yaitu berbanding sebagai bilangan yang mudah dan bulat". - Hukum Perbandingan Volume
Joseph Louis Gay-Lussac (1905) "Volume gas yang berreaksi dan gas hasil reaksi , bila diukur pada suhu dan tekanan yang sama akan berbanding sebagai bilangan bulat yang sederhana". - Hukum Avogadro
Amadeo Avogadro (1911) "Pada suhu dan tekanan yang tetap, semua gas yang volumenya sama akan mengandung molekul yang sama jumlanya. - Hukum Boyle-Gay Lussac
Untuk gas dengan massa tertentu, maka hasil kali volume dengan tekanan dibagi oleh suhu yang diukur dalam kelvin adalah tetap.
Massa Atom Relatif (Ar) Adalah Perbandingan massa suatu atom atau seatu unsur terhadap massa suatu atom unsur baku. IUPAC (Internasional union of pure and applied chemistry) menetapkan isotop karbon-12 sebagai standar atom unsur baku yang masanya tepat 12 satuan massa atom (sma). Dengan kata lain Masa atom relatif merupakan massa atom suatu unsur dibandinkan dengan 1/12 massa satu atom isotop karbon-12 (12C)
Massa Molekul relatif (Mr) adalah bilangan yang menyatakan jumlah massa atom relatif dari unsur-unsur penyusun rumus molekul tersebut.
Rumus Empiris adalah rumus kimia yang paling sederhana, yang menyatakan jumlah relatif setiap atom yang tedapat dalah senyawa itu.
Contoh :CH2O,CH.
Rumus Molekul suatu zat menunjukkan jumlah atom yang sebenarnya, yang terdapat dalah suatu molekul zat tersebut.
Contoh : C2H6, C6H12O6, P4O10.
Rumus Mol
1. Menggunakan Gram dan Ar
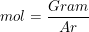
2. Menggunakan Gram dan Mr
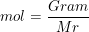
3. Menggunakan bilangan Avogadro (6,023x1023) dan jumlah partikel
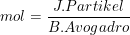
4. Keadaan standar (STP) "Volume satu mol gas sama dengan 22,4 liter.
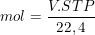
5. Bukan Keadaan Standar (bukan STP)
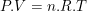
Keterangan :P= Tekanan, V=Volume, n=Mol, R=tetapan gas (0,082liter atm/mol/k) T=suhu dalak kelvin.
6.Pada Keadaan Sembarang
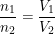
7. Mengunakan rumus Molaritas
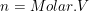
8. Menggunakan rumus Molalitas
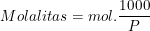
9. Fraksi mol
Xa= fraksi mol A, Xb=fraksi mol b , Xa+Xb=1,
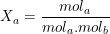 Atau
Atau 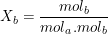 .
.
10.Rumus Penurunan Titik beku larutan elektrolit (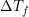 ) yang
) yang 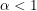 .
.

11. Rumus Kenaikan titik didih (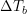 ) yang
) yang 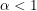
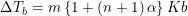
Massa Molekul relatif (Mr) adalah bilangan yang menyatakan jumlah massa atom relatif dari unsur-unsur penyusun rumus molekul tersebut.
Rumus Empiris adalah rumus kimia yang paling sederhana, yang menyatakan jumlah relatif setiap atom yang tedapat dalah senyawa itu.
Contoh :CH2O,CH.
Rumus Molekul suatu zat menunjukkan jumlah atom yang sebenarnya, yang terdapat dalah suatu molekul zat tersebut.
Contoh : C2H6, C6H12O6, P4O10.
Rumus Mol
1. Menggunakan Gram dan Ar
2. Menggunakan Gram dan Mr
3. Menggunakan bilangan Avogadro (6,023x1023) dan jumlah partikel
4. Keadaan standar (STP) "Volume satu mol gas sama dengan 22,4 liter.
5. Bukan Keadaan Standar (bukan STP)
Keterangan :P= Tekanan, V=Volume, n=Mol, R=tetapan gas (0,082liter atm/mol/k) T=suhu dalak kelvin.
6.Pada Keadaan Sembarang
7. Mengunakan rumus Molaritas
8. Menggunakan rumus Molalitas
9. Fraksi mol
Xa= fraksi mol A, Xb=fraksi mol b , Xa+Xb=1,
10.Rumus Penurunan Titik beku larutan elektrolit (
11. Rumus Kenaikan titik didih (

No comments:
Post a Comment